Contente
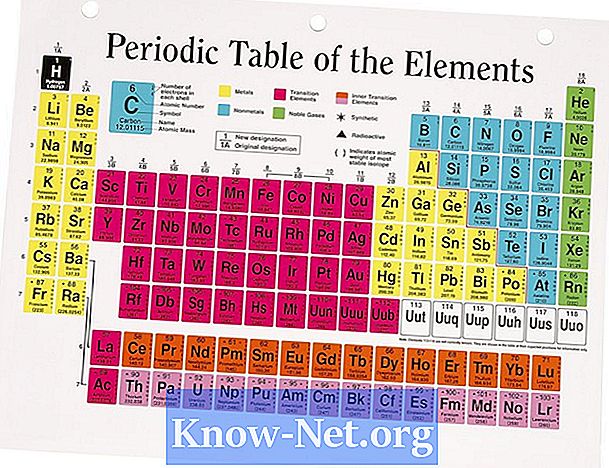
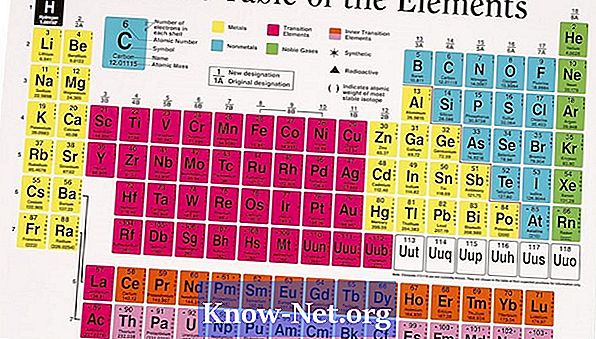
A maior parte dos elementos existe na natureza na forma de mais de um isótopo. A abundância dos isótopos que ocorrem naturalmente afeta a massa atômica média do elemento. A massa atômica encontrada na tabela periódica é a média dos valores dos vários isótopos que leva em consideração a abundância de cada um deles. Para elementos que têm apenas um isótopo, a massa atômica é próxima ao valor esperado com base no número de prótons e nêutrons no núcleo.
Instruções
-
Veja o possível isótopo do elemento de interesse. Todos os elementos têm um isótopo no mínimo. Para calcular a massa atômica média, você precisa saber quantos isótopos existem, suas abundâncias e suas massas atômicas.
-
Encontre a abundância natural de cada isótopo e anote esses valores com o número isotópico do elemento.
-
Calcule a massa atômica, utilizando uma média ponderada. Multiplique cada isótopo por sua abundância percentual e some todos os valores. Por exemplo, o magnésio tem três isótopos: Mg(24), Mg(25) e Mg(26), cujas abundâncias percentuais são 78,9%, 10% e 11,1% e cujas massas são 23,985, 24,986 e 25,983, respectivamente. A média ponderada é calculada a partir da fórmula (porcentagem 1 x massa atômica) + (porcentagem 2 x massa atômica) + (porcentagem 3 x massa atômica) = (0,789 x 23,985) + (0,1 x 24,986) + (0,111 x 25,983) = 18,924 + 2,499 + 2,884 = 24,307. O valor publicado é 24,305. O arredondamento dos valores justifica a leve diferença.
O que você precisa
- Isótopos do elemento
- Abundâncias percentuais


